本ニュースリリースは、当社とMEI Pharma, Inc.が発表した英文プレスリリースの内容を、当社が日本語に翻訳、再構成し、発表しています。本ニュースリリースの正式言語は英語であり、その内容・解釈については英語が優先しますことにご留意下さい。協和キリン 英語リリース![]()
ザンデリシブの臨床試験データを2022年ASCO(米国臨床腫瘍学会)で発表
- 客観的奏効率(ORR)70.3%、完全奏効率(CR)35.2%
- 奏効した症例のうち87.5%は投与開始後2サイクル以内、完全奏効した症例のうち75%は4サイクル以内に観察
- 薬剤に関連する有害事象で治療を中止した症例は9.9%
- Grade 3の有害事象のうち83%は投与開始後3サイクル以内に観察
協和キリン株式会社(本社:東京、代表取締役社長:宮本昌志、以下「協和キリン」)とMEI Pharma, Inc.(本社:米国サンディエゴ、社長兼 CEO:Daniel Gold、以下「MEI」)は、本日、B細胞悪性腫瘍の治療薬として開発中のホスファチジルイノシトール3-キナーゼデルタ(PI3Kδ)阻害剤であるザンデリシブ(開発番号:ME-401)の単剤療法を間歇投与法で評価する国際共同第2相試験のデータを2022年米国臨床腫瘍学会で報告したことをお知らせします。
MEIのchief medical officerであるRichard Ghalie, M.D.は、「これまでに得られたTIDAL試験のデータは、ザンデリシブのプロファイルと患者さんに利益をもたらす可能性を支持する結果であり、パートナーである協和キリンと既に進行中のランダム化比較試験の第3相COASTAL試験(少なくとも1種類の治療歴を有する濾胞性および辺縁帯リンパ腫患者におけるザンデリシブとリツキシマブの併用効果を評価する第3相ランダム化比較試験)に対する当社の取り組みを後押しするものです。TIDAL試験の有望な結果を踏まえ、私たちは、特にCOASTAL試験に焦点を当てて、引き続きザンデリシブのプログラムを進めます」と述べています。
協和キリンの執行役員 研究開発本部長 鳥居義史は、「ASCOでTIDAL試験のデータを発表できたことを大変うれしく思います。本試験において、ザンデリシブの有効性と安全性のバランスが取れた良好なプロファイルを引き続き確認することができました。当社は、パートナーのMEIとともに、B細胞悪性腫瘍の治療におけるザンデリシブの価値を最大化するために引き続き尽力します」と述べています。
- 再発または難治性の濾胞性リンパ腫を対象としたTIDAL試験のデータ
-
- 発表演題:Efficacy and safety of zandelisib administered by intermittent dosing (ID) in patients with relapsed or refractory (R/R) follicular lymphoma (FL): Primary analysis of the global phase 2 study TIDAL
- セッション:Hematologic Malignancies—Lymphoma and Chronic Lymphocytic Leukemia
- 発表者:Andrew David Zelenetz, Ph.D., M.D.
- ポスターID:7511 / 165
- 試験の詳細
現在進行中のTIDAL試験(NCT03768505)は、ザンデリシブ単剤を評価する非盲検の国際共同第2相試験で、化学療法や抗CD20抗体を含む、少なくとも2回の全身療法歴がある再発・難治性の濾胞性リンパ腫および辺縁帯リンパ腫を対象としています。導入療法としてザンデリシブを1日1回2サイクル(1サイクル = 28日)投与し、その後は各サイクルの最初の7日間だけ1日1回投与する、間歇投与療法(IDT, Intermittent Dosing Therapy)を実施しました。濾胞性リンパ腫コホートへの登録は完了し、辺縁帯リンパ腫コホートへの登録は継続中です。
濾胞性リンパ腫コホートでは合計121名の症例が登録され、そのうち91名が客観的奏効率(ORR)と奏効効期間(DOR)を評価するための解析対象集団として登録されました。
濾胞性リンパ腫症例の年齢中央値は64歳で、同コホートの症例の前治療歴の中央値は3回(2-8回)であり、96%の症例が免疫化学療法の前治療を受けていました。さらに、28名(23%)が幹細胞移植を受けたことがあり、50名(41%)が直近の前治療に対して抵抗性を示し、41名(34%)が5cm以上の腫瘍を有し、68名(56%)がPOD24(初発治療後24ヵ月以内に病勢進行)でした。
本試験の主要評価項目は、独立評価委員会の評価による客観的奏効率です。データカットオフの日は、最後の症例がザンデリシブの初回投与を受けてから約6カ月後の2021年9月30日です。症例登録中の辺縁帯リンパ腫コホートのデータは報告対象外です。
- 有効性
本解析対象集団である再発または難治性の濾胞性リンパ腫症例91名における主要評価項目である客観的奏効率は70.3%(64名、95%信頼区間:59.8~79.5%)でした。また、完全奏効率は35.2%(32名、95%信頼区間:25.4~45.9%)でした。複数のサブグループ(以下表)において、客観的奏効率は63%を上回っていました。
全奏効症例のうち投与開始後2サイクルで奏効したのが87.5%(56名)、完全奏効を得られた症例のうち75%(24名)が最初の4サイクルで完全奏効しました。データカットオフ日時点では追跡期間が不十分なため、本解析対象集団における最終的な奏効期間の正確な算出には至っておりません。
- 独立評価委員会による有効性解析対象集団全体及びサブグループにおける奏効率
-
この表はスクロールしてご覧いただけます
Response to Last Treatment Number of Prior Therapies POD24 n(%) Efficacy Population (n=91) Relapsed (n=49) Refractory (n=42) 2 (n=42) >2 (n=49) Yes (n=51) No (n=40) ORR
(CR or PR)64 (70.3) 37 (75.5) 27 (64.3) 33 (78.6) 31 (63.3) 34 (66.7) 30 (75.0) CR 32 (35.2) 20 (40.8) 12 (28.6) 18 (42.9) 14 (28.6) 16 (31.4) 16 (40.0) CR, complete response; PEP, primary efficacy population; POD24, progression of disease within 24 months; PR, partial response.
- 安全性と忍容性
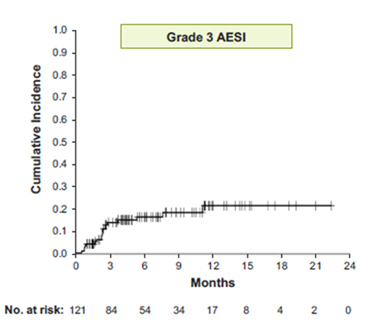
- データカットオフ日時点で、濾胞性リンパ腫コホート全体(121名)の追跡期間の中央値は9.4か月(範囲:0.8-24か月)で、グレード3の注目すべき有害事象の発現率は、下痢が5%、大腸炎が1.7%、皮疹が3.3%、粘膜炎が2.5%、ALT/AST上昇と非感染性肺炎がそれぞれ0.8%でした。また、薬剤に関連する有害事象による中止率は9.9%でした。グレード3の注目すべき有害事象(18名)は、83%(15名)が第1~3サイクル目であらわれ、4サイクル目以降ではわずか3例のみに認められました。グレード 4 または 5 の注目すべき有害事象は認められませんでした。試験治療下でのCOVID-19感染症の発現率は8.3%(10名)、その他のグレード3の感染症は8.3%(10名)でした。COVID-19による感染症では4例が死亡し、肺炎と腫瘍崩壊症候群がそれぞれ1例ずつ報告されました。
- グレード3の有害事象発生率の経時変化
-
- ザンデリシブについて
-
本剤は選択的PI3Kδ阻害剤であり、B細胞悪性腫瘍症例を対象に、1日1回投与の経口治療薬として開発されています。臨床試験では、B細胞悪性腫瘍症例の治療において、単剤および他の治療法との併用で、間歇投与療法(IDT)を用いて本剤の有効性と安全性を検討しています。IDTは本剤に特有の分子的・生物学的特性を活用するものです。
2021年11月、MEIと協和キリンは、少なくとも2回以上の全身療法歴のある濾胞性リンパ腫症例を対象に、本剤を単剤で評価する第2相TIDAL試験(NCT03768505
 )のデータを発表しました(プレスリリース)。本剤は主要評価項目の解析対象集団(n=91)において、独立評価委員会の評価で70.3%の客観的奏効率(ORR)を示しました。また、35.2%が完全奏効を達成しました。なおデータカットオフ時点では、奏効期間(DOR)を正確に推定するためのデータは十分には蓄積されていませんが、以前に報告した第 1b 相試験のデータと同様、本剤は概ね良好な忍容性を示しました。濾胞性リンパ腫コホート全体(N=121)の追跡期間中央値は9.4カ月(範囲:0.8~24)であり、中間データでは有害事象による中止率が9.9%でした。本試験の登録症例は、安全性とDORを確認するために、引き続き追跡調査が行われます。
)のデータを発表しました(プレスリリース)。本剤は主要評価項目の解析対象集団(n=91)において、独立評価委員会の評価で70.3%の客観的奏効率(ORR)を示しました。また、35.2%が完全奏効を達成しました。なおデータカットオフ時点では、奏効期間(DOR)を正確に推定するためのデータは十分には蓄積されていませんが、以前に報告した第 1b 相試験のデータと同様、本剤は概ね良好な忍容性を示しました。濾胞性リンパ腫コホート全体(N=121)の追跡期間中央値は9.4カ月(範囲:0.8~24)であり、中間データでは有害事象による中止率が9.9%でした。本試験の登録症例は、安全性とDORを確認するために、引き続き追跡調査が行われます。現在進行中のザンデリシブの主な試験としては、TIDAL試験(NCT03768505
 )があります。TIDAL試験は、再発または難治性の辺縁帯リンパ腫症例を評価するコホートと、再発または難治性の濾胞性リンパ腫症例を評価するコホートを含む試験です。また、抗CD20抗体と化学療法またはレナリドミドの併用療法を含む前治療歴が少なくとも1回ある再発および難治性の濾胞性リンパ腫または辺縁帯リンパ腫症例を対象に、ザンデリシブとリツキシマブを標準治療の化学療法とリツキシマブの併用療法と比較する第3相COASTAL試験(NCT04745832
)があります。TIDAL試験は、再発または難治性の辺縁帯リンパ腫症例を評価するコホートと、再発または難治性の濾胞性リンパ腫症例を評価するコホートを含む試験です。また、抗CD20抗体と化学療法またはレナリドミドの併用療法を含む前治療歴が少なくとも1回ある再発および難治性の濾胞性リンパ腫または辺縁帯リンパ腫症例を対象に、ザンデリシブとリツキシマブを標準治療の化学療法とリツキシマブの併用療法と比較する第3相COASTAL試験(NCT04745832 )が現在進行中であり、本試験ではザンデリシブの間歇投与法についても評価を行っております。COASTAL試験は、米国および世界各国での薬事承認申請をサポートすることを目的としています。
)が現在進行中であり、本試験ではザンデリシブの間歇投与法についても評価を行っております。COASTAL試験は、米国および世界各国での薬事承認申請をサポートすることを目的としています。その他の進行中の試験としては、協和キリンが日本で実施している低悪性度B細胞性非ホジキンリンパ腫(小リンパ球性リンパ腫、リンパ形質細胞性リンパ腫、ワルデンストレームマクログロブリン血症を除く)を対象とした第2相試験(NCT04533581
 )があります。
)があります。2020年3月、FDA(米国食品医薬品局)より、少なくとも2回以上の全身治療歴のある再発または難治性の濾胞性リンパ腫症例に対する治療薬として、本剤が米国でファスト・トラックに指定されました。さらに2021年11月、FDAより、濾胞性リンパ腫症例の治療薬として、本剤が米国で希少疾病用医薬品に指定されました。
2020年4月、MEIと協和キリンは、ザンデリシブの開発および商業化のためのグローバルライセンス契約を締結しました。MEIと協和キリンは、米国におけるザンデリシブの共同開発および共同販促を行い、米国での売上はすべてMEIが計上、利益と費用は両社50:50の比率でシェアします。米国外での独占的商業化権は協和キリンが有します。
- 濾胞性リンパ腫について
- 濾胞性リンパ腫は全ての非ホジキンリンパ腫(NHL)のうち約20-30%を占める、最も代表的な低悪性度リンパ腫です。この疾患はリンパ球と呼ばれる白血球の1つであるB細胞で生じ、大半の症例では緩やかに進行する傾向を示します。診断時年齢の中央値は65歳と高齢者に多く、進行型のNHLであるびまん性大細胞型B細胞リンパ腫に転化することがあります。
